Données relatives à l’efficacité

Dans l'essai clinique EFFISAYIL® 1, l'évaluation globale du psoriasis pustuleux généralisé faite par le médecin (score GPPGA), qui va de 0 (aucune pustule visible) à 4 (grave), a été utilisée pour évaluer l'efficacité de SPEVIGO® IV.
À la semaine 1, SPEVIGO® IV a été associé à une efficacité démontrée des paramètres d’évaluation principaux et secondaires par rapport au placebo1* :
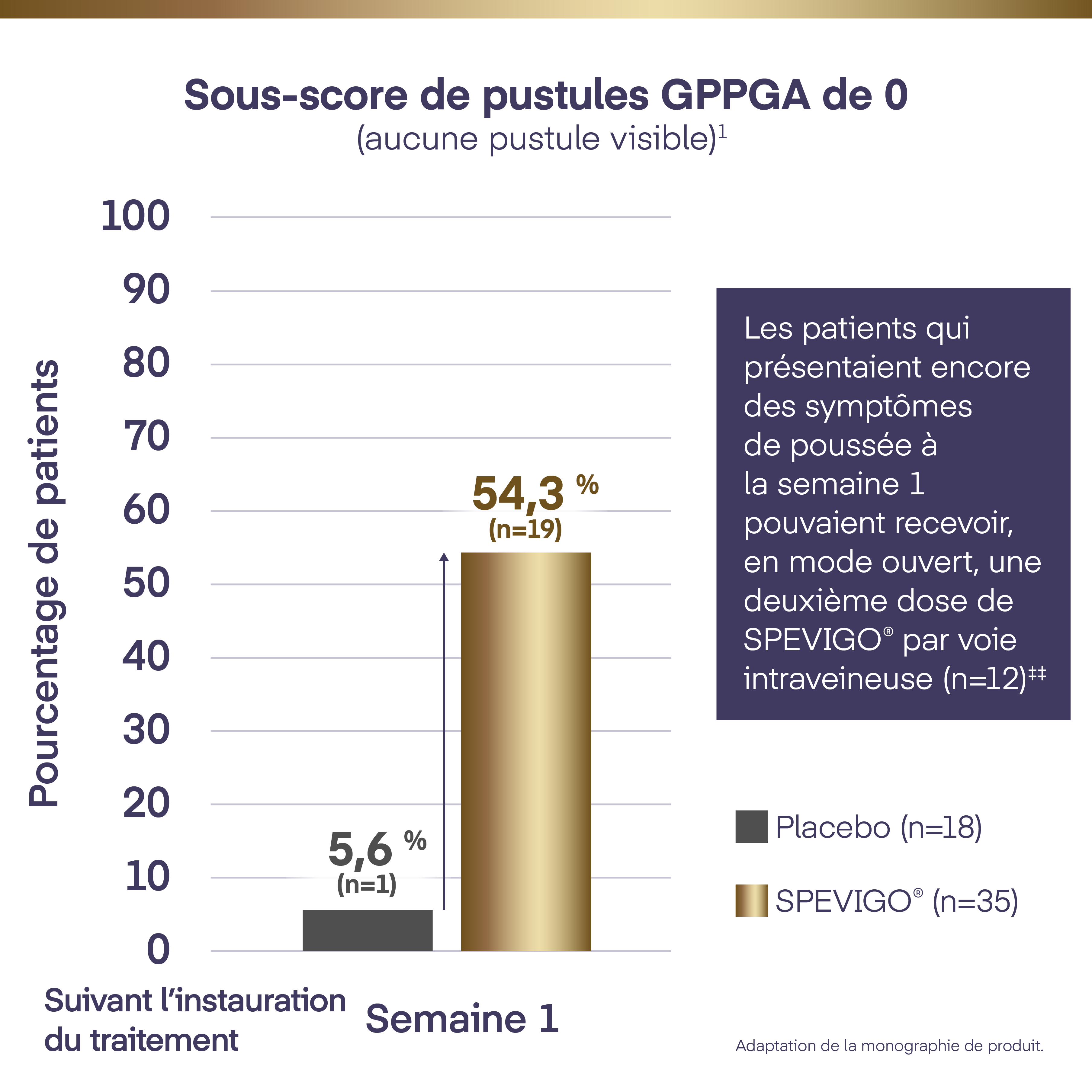
Sous-score de pustules GPPGA de 0 (aucune pustule visible) : 54,3 % (n=19) par rapport à 5,6 % (n=1) avec placebo (p=0,0004†) (paramètre d’évaluation principal)
Score total GPPGA de 0 ou 1 (peau claire ou presque claire) : 42,9 % (n=15) par rapport à 11,1 % (n=2) avec placebo (p=0,0118†) (paramètre d’évaluation secondaire)
Dans l'essai clinique de phase IIb EFFISAYIL® 2, l’efficacité et l’innocuité de SPEVIGO® SC ont été évaluées.
SPEVIGO® SC a été associé à une efficacité pour ce qui est des paramètres d’évaluation principaux et secondaires clés par rapport au placebo‡ :
SPEVIGO® SC a prolongé de manière significative le temps écoulé avant la première poussée de PPG jusqu’à la semaine 48 (RRI§ : 0,16 [IC à 95 % : 0,05, 0,54]; p=0,0005¶; 10 % [n=30] pour SPEVIGO® vs 51,6 % [n=31] pour placebo)1,3,4||
- Un nombre significativement moindre de patients a présenté ≥1 poussée de PPG jusqu’à la semaine 48 avec SPEVIGO® SC comparativement au placebo : 10 % (n=30) vs 51,6 % (n=31), respectivement (taux de différence corrigé : -39,0 % [IC à 95 % : -62,1, -15,9]; p=0,0013**, paramètre d’évaluation secondaire clé)1,3,4||
DONNÉES DE L’ESSAI EFFISAYIL® 1
Suivant l’administration d’une dose unique de SPEVIGO®, 54,3 % (n=19) des patients ont obtenu un sous-score de pustules GPPGA de 0 (aucune pustule visible) à la semaine 1 par rapport à 5,6 % (n=1) des patients ayant reçu le placebo (p=0,0004)1*†
Suivant l’administration d’une dose unique de SPEVIGO® IV, 42,9 % (n=15) des patients ont obtenu un score total GPPGA de 0 ou 1 à la semaine 1 par rapport à 11,1 % (n=2) des patients sous placebo (p=0,0118)1*†.
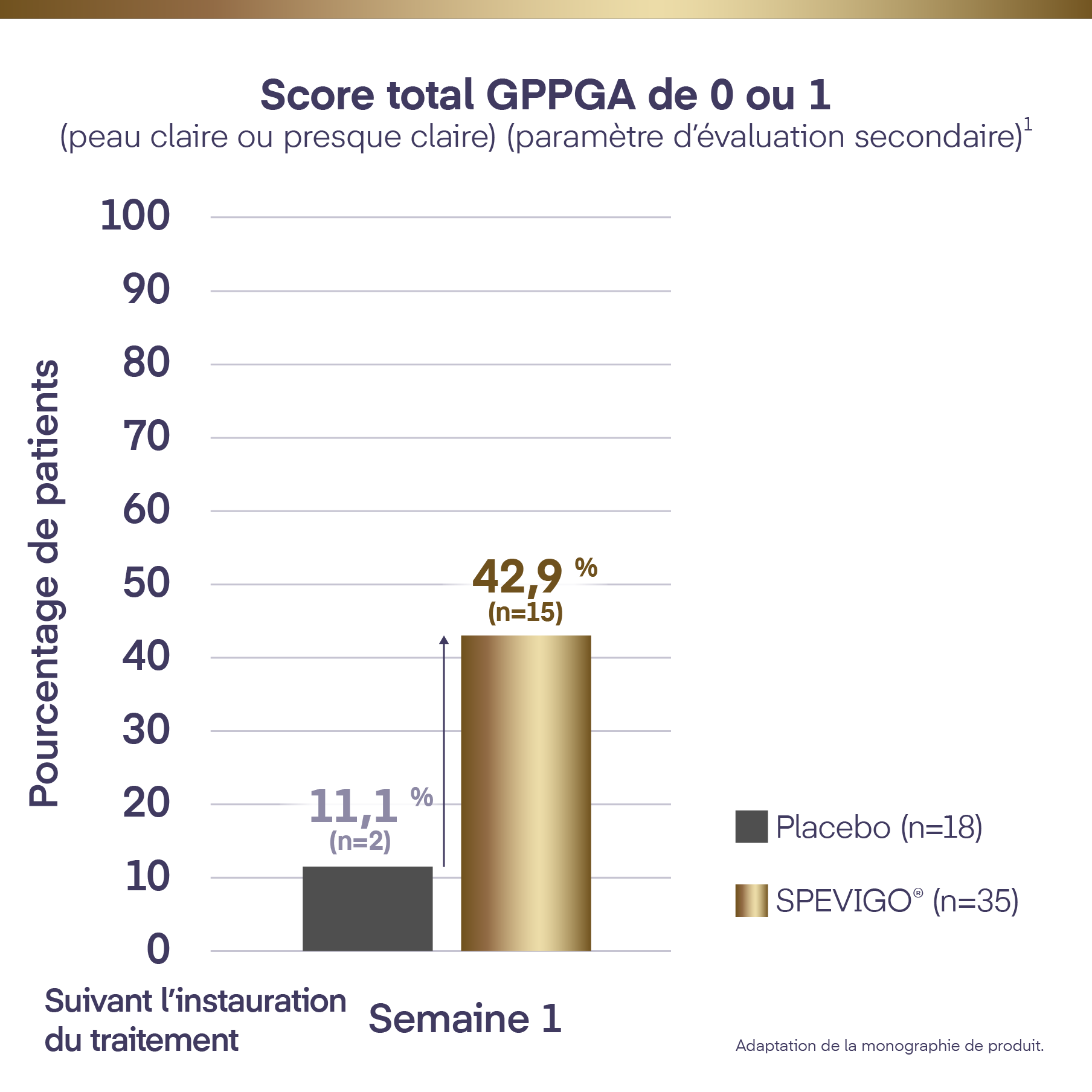
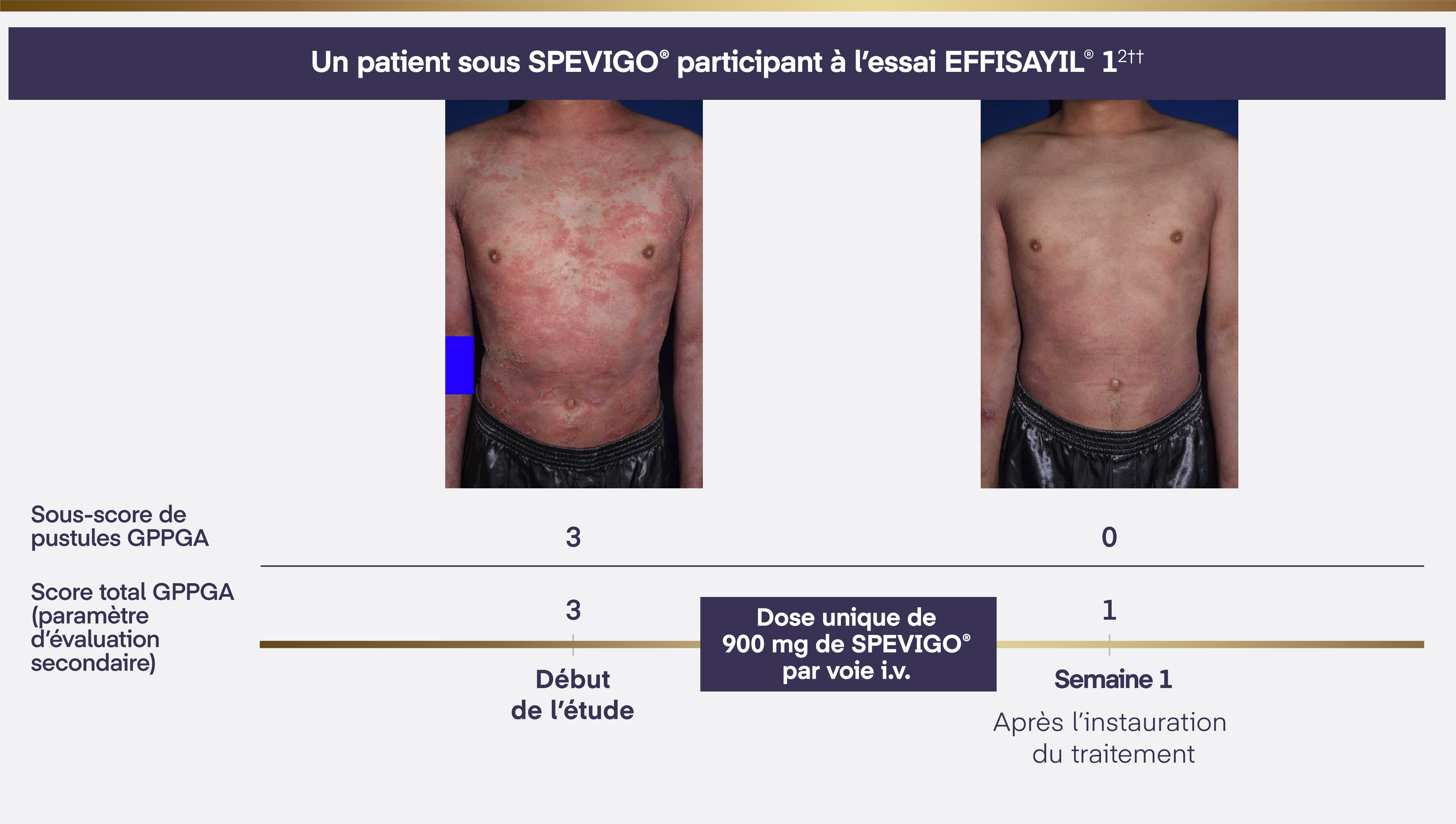
Image d’un patient sous SPEVIGO®. Utilisée avec permission.
DONNÉES DE L’ESSAI EFFISAYIL® 2
Il a été démontré que SPEVIGO® SC est associé à une supériorité significative sur le plan statistique par rapport au placebo pour ce qui est du temps écoulé avant la première poussée de PPG jusqu’à la semaine 481,3||.

Adaptation de la monographie de produit.
Les résultats du paramètre d’évaluation principal concordaient en général dans les sous-groupes, y compris le sexe, l’âge, la race, l’IMC, le poids corporel, le statut mutationnel du gène IL36RN, le psoriasis en plaques concomitant, le score GPPGA total au début de l’étude, et peu importe tout traitement systémique de PPG au moment de la répartition aléatoire.
-
IC=intervalle de confiance; RRI=rapport des risques instantanés; i.v.= intraveineux; s.-c.=sous-cutané.
-
*
EFFISAYIL® 1 : Essai à répartition aléatoire, à double insu et contrôlé par placebo mené auprès d’adultes présentant des poussées de PPG. Les patients ont été randomisés s'ils présentaient une poussée de PPG d'intensité modérée à grave, définie par un score total GPPGA (allant de 0 [aucune] à 4 [grave]) d'au moins 3 (intensité modérée), la présence de nouvelles pustules (nouvelles pustules ou aggravation des pustules), un sous-score de pustules GPPGA d'au moins 2 (intensité légère) et au moins 5 % de la surface corporelle recouverte d’érythème et de pustules. Les patients ont reçu une dose unique de 900 mg de SPEVIGO® administrée par voie intraveineuse (n=35) ou un placebo (n=18) et une seconde dose facultative au jour 8 (suivi jusqu'à 12 semaines). Les patients dans l’essai clinique EFFISAYIL® 1 peuvent recevoir jusqu’à 2 doses de 900 mg de SPEVIGO® IV. Le paramètre d’évaluation principal était la proportion de patients obtenant un sous-score de pustules GPPGA de 0 (indiquant l'absence de pustules visibles) à la semaine 1.
-
†
Valeur p unilatérale.
-
‡
EFFISAYIL® 2 : Une étude de phase IIb à répartition aléatoire, à double insu, contrôlée par placebo menée chez des patients qui sont des adultes et des adolescents (pesant au moins 40 kg) présentant des antécédents d’au moins deux poussées de PPG d'intensité modérée à grave dans le passé. Les patients ont été répartis aléatoirement s’ils avaient un score GPPGA total de 0 ou 1 au moment de la sélection et de la randomisation. Ces patients doivent avoir eu des antécédents de poussées en recevant des traitements concomitants pour le PPG ou des antécédents de poussées par suite d'une réduction de la dose ou l'abandon de ces médicaments concomitants. Bien que 3 schémas posologiques aient été évalués, le schéma posologique recommandé pour la prévention des poussées de PPG est une dose d’attaque de 600 mg de SPEVIGO® s.-c. suivie d’une dose de 300 mg, s.-c. toutes les 4 semaines. Les patients qui ont présenté une poussée étaient admissibles à recevoir jusqu’à deux doses i.v. en mode ouvert de SPEVIGO®. Le paramètre d’évaluation principal était le temps écoulé avant la première poussée de PPG, jusqu’à la semaine 48 (définie par un sous-score de pustule GPPGA ≥2 et une augmentation du score GPPGA total de ≥2 par rapport au début). Le paramètre d’évaluation secondaire clé de l’étude était la survenue d’au moins une poussée de PPG jusqu’à la semaine 48.
-
§
Modèle de régression de Cox stratifié en fonction de l’utilisation de traitements à action générale du PPG au moment de la répartition aléatoire.
-
¶
Test logarithmique par rangs stratifié en fonction de l’utilisation de médicaments à action générale contre le PPG au moment de la répartition aléatoire, valeur p unilatérale.
-
||
L’utilisation du traitement par SPEVIGO® IV ou du traitement standard prescrit par l’investigateur pour traiter l’aggravation du PPG ont été pris en compte au début de la poussée de PPG.
-
**
Test Cochran-Mantel-Haenszel après une imputation multiple, stratifiée en fonction de l’utilisation de médicaments à action générale contre le PPG au moment de la répartition aléatoire, valeur p unilatérale.
-
††
Patient sous SPEVIGO®; peut ne pas être représentatif de tous les patients. Les résultats individuels peuvent varier.
-
‡‡
Les patients de l'un ou l'autre groupe de traitement qui présentaient encore des symptômes de poussée à la semaine 1 étaient admissibles à recevoir, en mode ouvert, une dose unique de 900 mg de SPEVIGO® par voie intraveineuse; ainsi, 12 patients (34 %) du groupe SPEVIGO® ont reçu une deuxième dose de SPEVIGO® et 15 patients (83 %) du groupe placebo ont reçu une dose de SPEVIGO® au jour 8. En outre, 6 patients (4 dans le groupe SPEVIGO®; 2 dans le groupe placebo) ont reçu un traitement de secours sous forme d’une dose unique de 900 mg de SPEVIGO® par voie intraveineuse en cas de réapparition d'une poussée après le jour 8.


